
La energía de ionización puede definirse como la cantidad mínima de energía necesaria para extraer el electrón de valencia, es decir, el electrón menos ligado, de un átomo gaseoso aislado o de un ion. Es importante tener en cuenta el término átomo gaseoso aislado, ya que si el átomo no está aislado, entonces la energía requerida puede ser mayor debido a las fuerzas interatómicas.
Conozcamos en detalle la Energía de Ionización en este artículo.
¿Qué es la Energía de Ionización?
La energía de ionización se define como la dificultad para eliminar el electrón de un átomo o ion.
La ionización es un proceso endotérmico, ya que es necesario suministrar energía para eliminar el electrón. La energía de ionización aumenta a medida que se retiran los electrones, ya que el átomo adquiere una carga positiva y los electrones se retienen con más fuerza. Por lo tanto, es difícil eliminar un electrón de un catión.
La energía de ionización o potencial de ionización se mide en electronvoltios (eV) o KJ/mol. eV es la unidad preferida en física, mientras que kJ/mol es la unidad preferida en química, ya que la química suele trabajar con 1 mol de átomo.
Factores que afectan la Energía de Ionización
Los factores que afectan a la Energía de Ionización de cualquier átomo y molécula son:
- Si un átomo o ion está cargado positivamente, los electrones están más pegados al núcleo, por lo que la energía de ionización es alta.
- Si el número de capas es menor, es decir, los electrones están cerca del núcleo, la energía de ionización es alta y viceversa.
- Por esta razón, es difícil eliminar los electrones internos en comparación con los externos.
- La energía de ionización es menor cuando hay más de 1 electrón en una capa debido a las repulsiones interelectrónicas.
- Un átomo con energía de ionización más bajo actúa como un buen agente reductor, mientras que aquellos con energía de ionización alto actúan como un buen agente oxidante.
Energía de Ionización y Modelo Atómico de Bohr
La energía de ionización atómica puede predecirse utilizando el modelo de átomo de Bohr. Su modelo predice la presencia de varios caminos para que el electrón rodee el núcleo que contiene protones y neutrones. Cada camino u órbita está a una distancia fija del núcleo, y también representa una energía fija. El electrón es una partícula y tendrá la energía de la órbita presente. Una partícula puede absorber energía y saltar a las siguientes órbitas de mayor energía. Si dispone de más energía y la absorbe, el electrón saldrá de la fuerza de atracción del núcleo, lo que significa que saldrá del átomo.
Ionización
La ionización es un proceso que implica la eliminación de un electrón presente en una órbita exterior al átomo. Como el electrón en cada órbita tiene una energía característica, la energía de ionización es igual a la diferencia de energía entre la energía del electrón en la órbita inicial y la energía del electrón fuera del átomo (en la órbita infinita desde el núcleo).
La energía de un electrón en la órbita ‘n’ se calcula mediante el modelo del átomo de Bohr como,
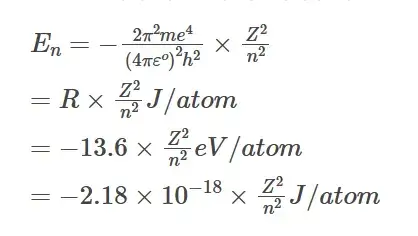
La energía de ionización para la eliminación de un electrón de un átomo neutro puede calcularse sustituyendo el número de órbita del electrón antes de la transición como ‘n1‘ y el número de órbita del electrón después de la transición como ‘∞’ (infinito) y ‘n2‘ en la ecuación de energía de Bohr.
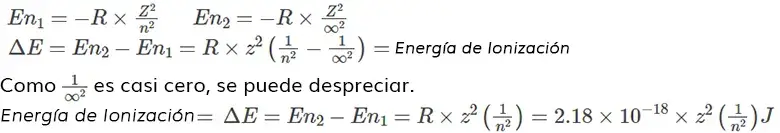
Energía de Ionización: Tabla Periódica
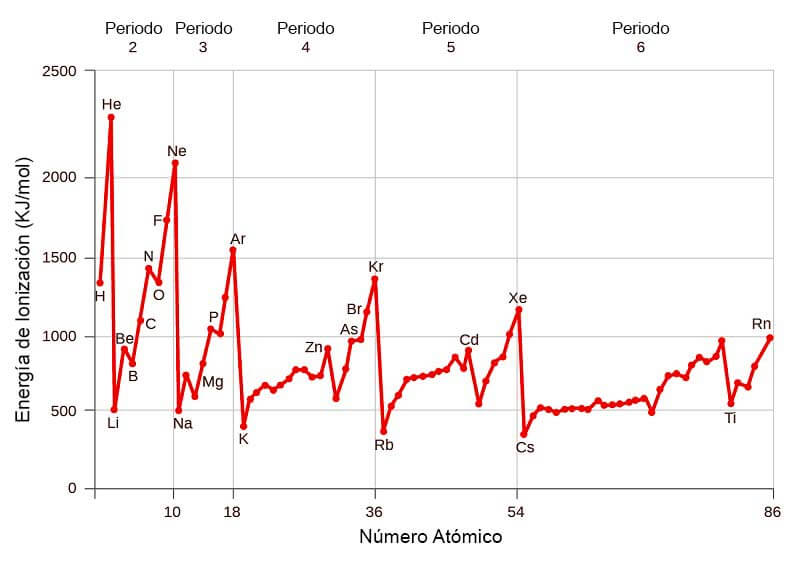
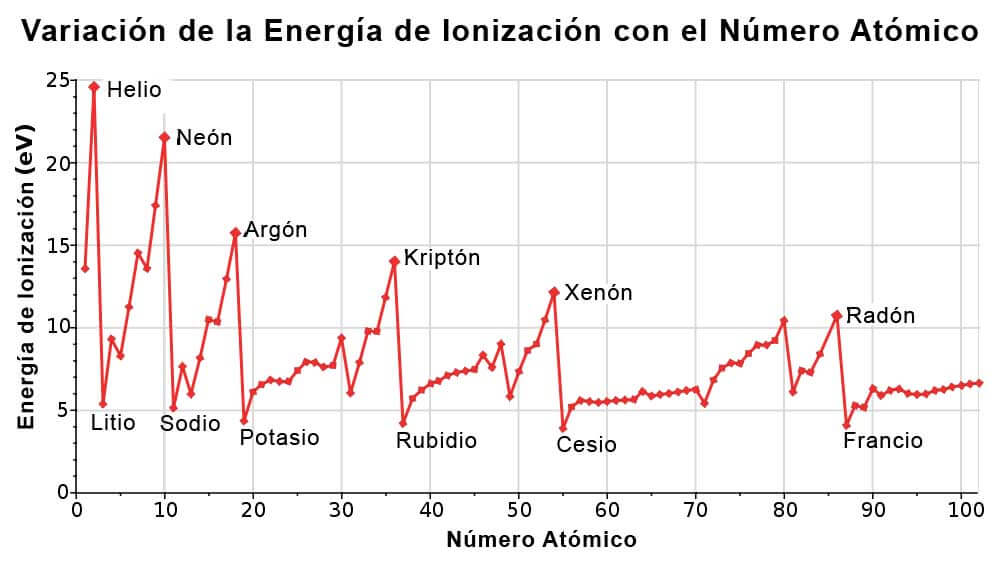
Como se ha descrito anteriormente, las energías de ionización dependen del radio atómico. Al ir de derecha a izquierda en la tabla periódica, el radio atómico aumenta, y la energía de ionización aumenta de izquierda a derecha en los periodos y hacia arriba en los grupos.
Las excepciones a esta tendencia se observan en los metales alcalinotérreos (grupo 2) y los elementos del grupo del nitrógeno (grupo 15).
Normalmente, los elementos del grupo 2 tienen una energía de ionización mayor que los elementos del grupo 13 y los elementos del grupo 15 tienen una energía de ionización mayor que los elementos del grupo 16.
Los grupos 2 y 15 tienen configuraciones electrónicas completamente llenas y semillenas respectivamente, por lo que se requiere más energía para eliminar un electrón de orbitales completamente llenos que de orbitales incompletamente llenos.

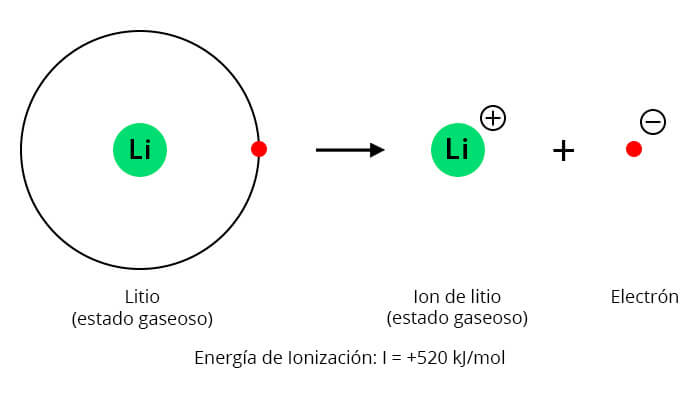
| Li 520 | Be 899 | B 800 | C 1086 | N 1402 | O 1314 | F 1680 |
| Li 520 |
| Na 496 |
| K 419 |
| Rb 408 |
| Cs 376 |
| Fr 398 |
¿Cómo calcular la energía de ionización?
La ionización de la energía debe calcularse para cada ion en la tabla periódica. Como tal, para comprender la ionización de la energía, es útil comprender las ecuaciones que se utilizan para calcular la cantidad de energía necesaria para expulsar electrones.
La ecuación básica para la energía de ionización es:
H(g) → H+(g) + e−
La cantidad de energía necesaria cambia cada vez que se libera un electrón, ya que se vuelve más difícil eliminar los electrones después de que uno o más ya han sido eliminados del átomo o molécula. Por lo tanto, la ecuación cambia.
Las diferentes ecuaciones son las siguientes:
- Primera ecuación de la energía de ionización (EI1)
M(g) → M+(g) + e– EI1
- Segunda ecuación de la Energía de Ionización (EI2)
M+(g) → M2+(g) + e– IE2
- Tercera ecuación de la Energía de Ionización (EI3)
M2+(g) → M3+(g) + e– IE3
Primera, Segunda y Tercera Energía de Ionización
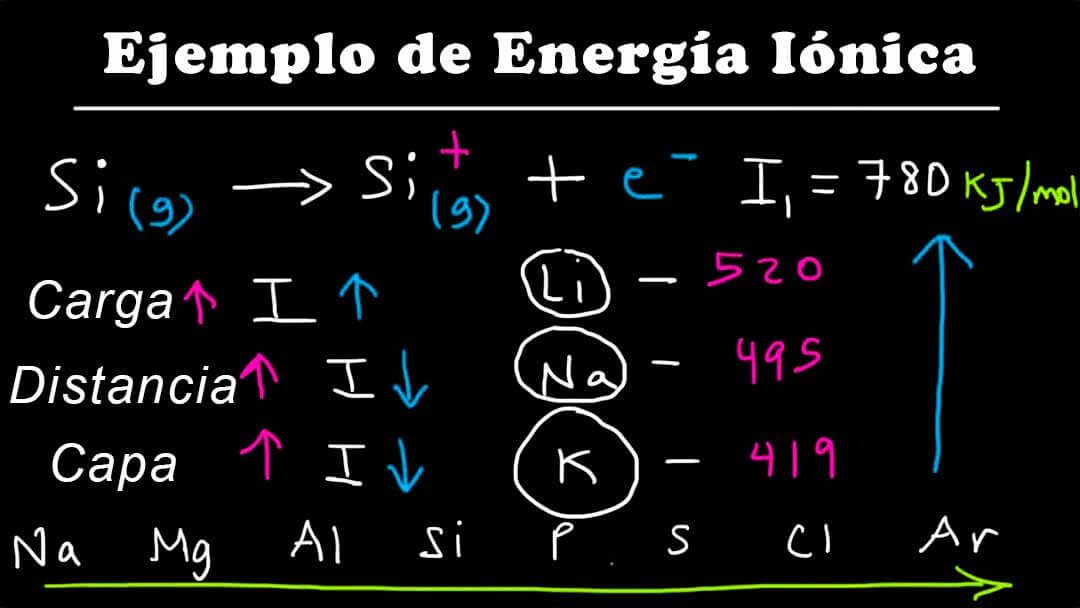
El símbolo I1 representa la primera energía de ionización (energía requerida para quitar un electrón de un átomo neutro) y el símbolo I2 representa la segunda energía de ionización (energía requerida para quitar un electrón de un átomo con una carga de +1). La energía de ionización sucesiva es mayor que la energía precedente. Esto significa que I1 <I2 <I3 <… <In y así sucesivamente.
Ejemplo de cómo la energía de ionización aumenta a medida que se eliminan los electrones sucesivos.
Mg(g) → Mg+ (g) + e− => I1 = 738 kJ/mol
Mg+(g) → Mg2+ (g) + e− => I2 = 1451 kJ/mol
Tabla 3: Energías de ionización (kJ / mol)
| EI1 | EI2 | EI3 | EI4 | EI5 | EI6 | EI7 | EI8 | |
| H | 1312 | |||||||
| He | 2372 | 5250 | ||||||
| Li | 520 | 7297 | 11810 | |||||
| Be | 899 | 1757 | 14845 | 21000 | ||||
| B | 800 | 2426 | 3659 | 25020 | 32820 | |||
| C | 1086 | 2352 | 4619 | 6221 | 37820 | 47260 | ||
| N | 1402 | 2855 | 4576 | 7473 | 9442 | 53250 | 64340 | |
| O | 1314 | 3388 | 5296 | 7467 | 10987 | 13320 | 71320 | 84070 |
| F | 1680 | 3375 | 6045 | 8408 | 11020 | 15160 | 17860 | 92010 |
| Ne | 2080 | 3963 | 6130 | 9361 | 12180 | 15240 | ||
| Na | 496 | 4563 | 6913 | 9541 | 13350 | 16600 | 20113 | 25666 |
| Mg | 737 | 1450 | 7731 | 10545 | 13627 | 17995 | 21700 | 25662 |
Variación de la Energía de Ionización en la Tabla Periódica
La Variación de la Energía de Ionización con respecto al Numero Atómico, es la siguiente:
Energía de ionización y afinidad electrónica
Tanto la energía de ionización como la afinidad electrónica tienen una tendencia similar en la tabla periódica. Por ejemplo, al igual que la energía de ionización aumenta a lo largo de los períodos, la afinidad de los electrones también aumenta. Del mismo modo, la afinidad de los electrones disminuye de arriba a abajo debido al mismo factor, es decir, al efecto de protección. Los halógenos pueden capturar un electrón fácilmente en comparación con los elementos del primer y segundo grupo. Esta tendencia a capturar un electrón en estado gaseoso se denomina electronegatividad. Esta tendencia también determina una de las diferencias químicas entre los elementos no metálicos y metálicos.
Tabla 4: muestra una tendencia creciente de afinidad electrónica de izquierda a derecha
| B 27 | C 123.4 | N 7 | O 142.5 | F 331.4 |
Tabla 5: muestra un patrón decreciente de las afinidades electrónicas de arriba a abajo
| H 73.5 |
| Li 60.4 |
| Na 53.2 |
| K 48.9 |
| Rb 47.4 |
| Cs 46.0 |
| Fr 44.5 |
Como se indicó anteriormente, los elementos del lado derecho de la tabla periódica (tabla 4) tienen tendencia a recibir el electrón, mientras que el de la izquierda es más electropositivo. Además, de izquierda a derecha, las características metálicas de los elementos disminuyen.
Ejemplos de energía de ionización
El término «ionización» se refiere al uso de calor, electricidad, productos químicos, descargas o radiación para transformar los átomos que son neutros en átomos con una carga eléctrica positiva o negativa.
Existen muchos ejemplos diferentes de ionización porque hay muchas situaciones en las que los átomos se transforman.
Algunos ejemplos con los que puede estar familiarizado son:
- Cuando el sodio y el cloro se combinan para producir sal, el átomo del sodio cede un electrón, lo que resulta en una carga positiva, mientras que el cloro obtiene el electrón y se carga negativamente como resultado.
- Cuando el gas de cloruro de hidrógeno y el agua previamente neutros se combinan, producen iones de hidronio que están cargados positivamente y los iones de cloruro cargados negativamente.
- Cuando el zinc se expone al ácido, pierde electrones y, por lo tanto, se carga positivamente.
En cada una de estas situaciones diferentes, la carga de los átomos cambia como resultado de la exposición a otros elementos o la combinación con otros elementos.
Ejemplos de Energía de Ionización
Esta tabla muestra ejemplos de los elementos que requieren más energía de ionización en el primer nivel de ionización.
| Número Atómico | Nombre | 1er nivel de energía de ionización |
|---|---|---|
| 2 | helio | 24.59 |
| 10 | neón | 21.56 |
| 9 | flúor | 17.42 |
| 18 | argón | 15.76 |
| 7 | nitrógeno | 14.53 |
| 36 | Kriptón | 14 |
| 8 | oxígeno | 13.62 |
| 17 | cloro | 12.97 |
| 54 | xenón | 12.13 |
| 6 | carbono | 11.26 |
Para convertir de eV a kJ/mol, multiplique por 96,4689. Algunos números varían en función del redondeo.
Para ver un ejemplo de energía de ionización, veamos el sodio. En este ejemplo de energía de ionización, Na significa sodio y e- es el electrón que se retira del átomo de sodio.
Primer nivel de ionización (IE1):
Na(g) → Na+(g) + e-
IE1 = 496 kJ/mol
Segundo nivel de ionización (IE2):
Na+(g) → Na2+(g) + e
IE2 = 4560 kJ/mol
Tercer nivel de ionización (IE3):
Na2+(g) → Na3+(g) + e
IE3 = 6913 kJ/mol
