
¿Qué es la Ley de Dalton?
La ley de presiones parciales de Dalton es una ley de los gases que establece que la presión total ejercida por una mezcla de gases es igual a la suma de las presiones parciales ejercidas por cada gas individual en la mezcla. Por ejemplo, la presión total ejercida por una mezcla de dos gases A y B es igual a la suma de las presiones parciales individuales ejercidas por el gas A y el gas B (como se ilustra a continuación).
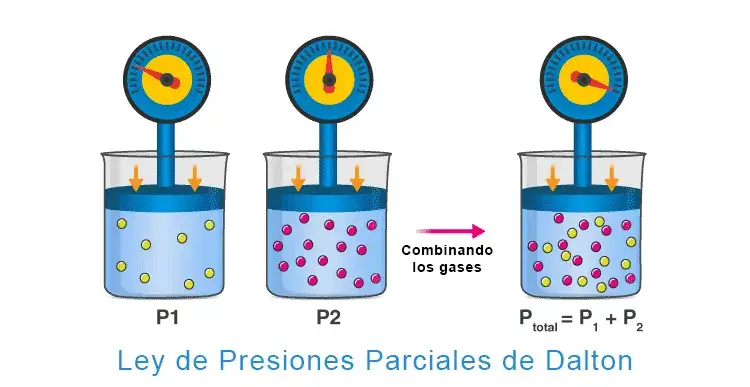
Fórmula de la Ley de Dalton
La ley de presiones parciales de Dalton se puede expresar matemáticamente de la siguiente manera:
Ptotal = P1 + P2 + P3 + …. + Pn
Donde,
Ptotal es la presión total ejercida por la mezcla de gases.
P1, P2,…, Pn son las presiones parciales de los gases 1, 2,…, ‘n’ en la mezcla de ‘n’ gases
Expresión de las Presiones Parciales en términos de Fracción Molar
La fracción molar de un gas específico en una mezcla de gases es igual a la relación entre la presión parcial de ese gas y la presión total ejercida por la mezcla gaseosa. Esta fracción molar también se puede utilizar para calcular el número total de moles de un gas constituyente cuando se conoce el número total de moles en la mezcla. Además, el volumen ocupado por un gas específico en una mezcla también se puede calcular con esta fracción molar con la ayuda de la ecuación que se proporciona a continuación.
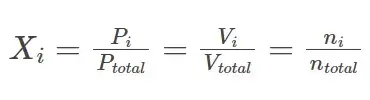
Donde Xi es la fracción molar de un gas «i» en una mezcla de «n» gases, «n» denota el número de moles, «P» denota presión y «V» denota volumen.
Ejemplos resueltos sobre la Ley de Presión Parcial de Dalton
Ejemplo 1
Una mezcla de hidrógeno gaseoso y oxígeno gaseoso ejerce una presión total de 1,5 atm sobre las paredes de su recipiente. Si la presión parcial del hidrógeno es de 1 atm, hallar la fracción molar de oxígeno en la mezcla.
Dado, Phidrógeno = 1 atm, Ptotal = 1,5 atm
Aplicando la fórmula de la ley de Dalton, Ptotal = PHidrógeno + POxígeno
Por lo tanto, Poxígeno = 0,5 atm
Ahora, la fracción molar de oxígeno, Xoxígeno = (Poxígeno/Ptotal) = 0,5/1,5 = 0,33
Por lo tanto, la fracción molar de oxígeno en la mezcla es 0,33
Ejemplo 2
A una temperatura de 300 K, 30 litros de gas A mantenidos a una presión de 1 atm y 15 litros de gas B mantenidos a una presión de 2 atm se transfieren a un recipiente vacío de 10 litros. Calcule la presión total dentro del recipiente y las presiones parciales del gas A y del gas B (suponga que A y B son gases ideales).
De la ecuación del gas ideal, PV = nRT
Número de moles de gas A = (30L*1atm)/(0.08206 atm.L.mol-1.K-1 * 300K) = 1.22 mol
Número de moles de gas B = (15*2atm)/(0.08206 atm.L.mol-1.K-1 * 300K) = 1.22 mol
Número total de moles en la mezcla gaseosa = 2,44 mol
Presión total dentro del recipiente de 10L = Ptot = nRT/V
Ptot = (2.44mol*0.08206 atm.L.mol-1.K-1*300K)/10L = 6.006 atm
Por tanto, la presión total dentro del recipiente de 10 litros es 6.006 atm.
Fracción molar de gas A = fracción molar de gas B = (1.22 mol/2.44 mol) = 0.5
Por lo tanto, presión parcial del gas A = presión parcial del gas B = 0,5*6,006 = 3,003 atm
Por tanto, las presiones parciales de los gases A y B en el recipiente de 10 litros son ambas iguales a 3.003 atm.
Para obtener más información sobre la ley de presiones parciales de Dalton y otras leyes importantes de los gases como la ley de Avogadro, ingrese a UnaEnergia.com.
