
La presión de vapor es un concepto crítico en el mundo de la ciencia que desempeña un papel vital en diversas industrias. En este artículo, nos sumergiremos en la ciencia que hay detrás de la presión de vapor, su importancia y sus aplicaciones en diferentes sectores. Al final del artículo, tendrá una sólida comprensión de este fascinante fenómeno.
¿Qué es la Presión de Vapor?
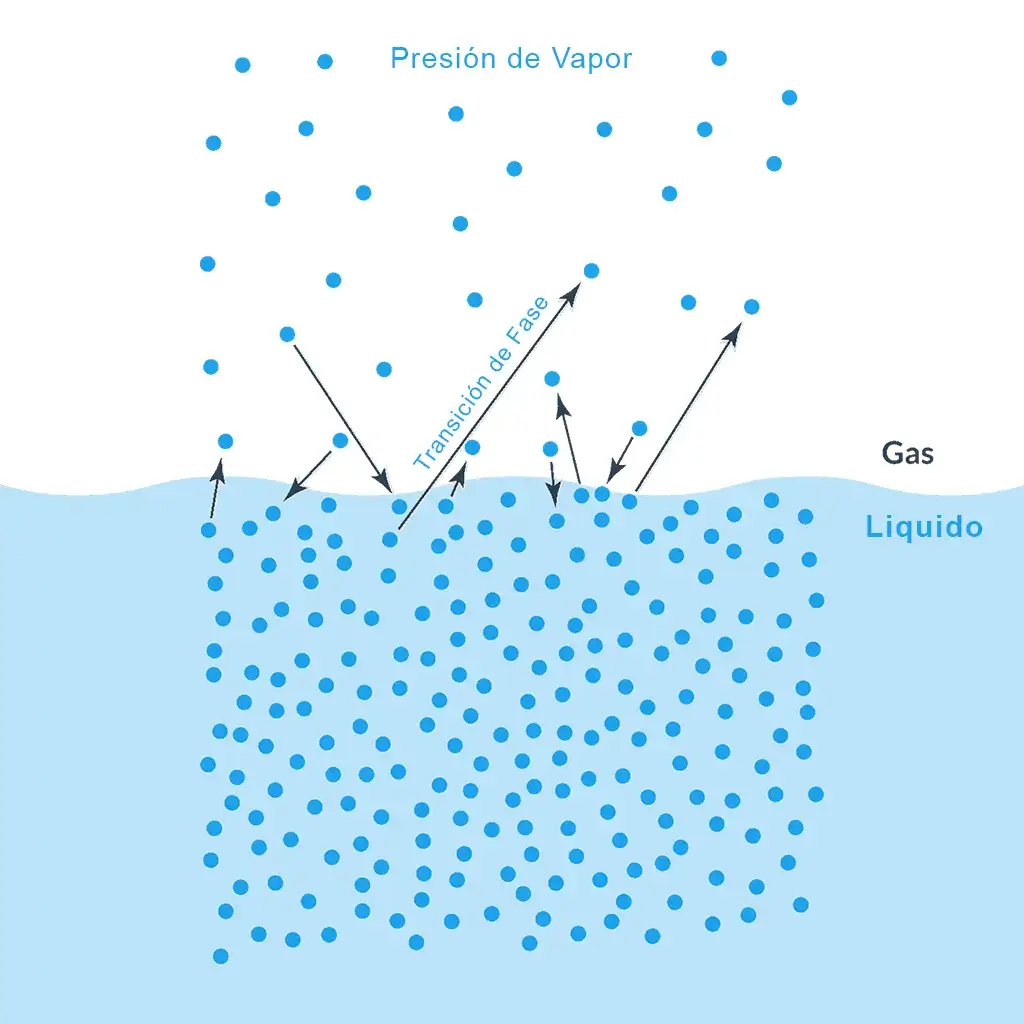
Cuando se coloca un líquido en un recipiente que se calienta continuamente, se observa que las moléculas del líquido se mueven a distintas velocidades en diferentes direcciones. Esto ocurre debido a las diferentes energías cinéticas que poseen las moléculas del líquido.
Cuando el líquido se calienta, la energía de las moléculas aumenta; se vuelve más ligero y ocupa la superficie del líquido. Este proceso se conoce como «evaporación». Las moléculas que pueden verse en la superficie del líquido se denominan «vapor».
La evaporación continúa a un ritmo constante y la temperatura del líquido se mantiene constante. Cuando algunas moléculas del líquido en fase vapor golpean las paredes de los recipientes o la superficie del líquido, pueden volver a convertirse en fase líquida. Este proceso se denomina condensación.
La presión de vapor, también conocida como presión de equilibrio de vapor, puede definirse como la presión ejercida (en un sistema en equilibrio termodinámico) por un vapor con sus fases condensadas (sólido o líquido) en un sistema cerrado a una temperatura determinada. Se sabe que la presión de vapor de equilibrio sirve de indicador de la velocidad de evaporación de un líquido. Se sabe que la propensión de las partículas a escapar del líquido (o de un sólido) está relacionada. Un material que, a temperaturas normales, tiene una presión de vapor elevada se suele denominar material volátil. Cabe señalar que la presión ejercida por el vapor sobre la superficie de un líquido se denomina presión de vapor.
Características de la Presión de Vapor
Sin embargo, a medida que pasa el tiempo, el número de moléculas en la fase de vapor aumenta, mientras que la velocidad de condensación también aumenta. Se llega a una fase en la que la velocidad de evaporación es igual a la velocidad de condensación. Esta fase se denomina fase de equilibrio.
Tal y como representa el manómetro, en este punto la presión ejercida por las moléculas se denomina presión de vapor del líquido. La presión de vapor se define como la presión ejercida por el vapor presente sobre el líquido.
La temperatura es el único factor que afecta a la presión de vapor. La presión de vapor de un líquido es independiente del volumen de líquido que contenga el recipiente, ya sea un litro o treinta litros; ambas muestras tendrán la misma presión de vapor a la misma temperatura. La temperatura tiene una relación exponencial con la presión de vapor, lo que significa que a medida que aumenta la temperatura, la presión de vapor también aumenta.
El proceso de evaporación depende de diferentes factores:
1. Naturaleza del líquido
Los líquidos tienen fuerzas intermoleculares débiles. Calentar las moléculas del líquido puede ayudar a cambiarlas a la fase de vapor y aumentar así la presión de vapor del líquido. Por ejemplo, la acetona y el benceno tienen mayor presión de vapor que el agua a una temperatura determinada.
2. Efecto de la temperatura
La presión de vapor del líquido aumenta con el incremento de su temperatura. Las moléculas del líquido tienen mayor energía a temperaturas más altas.
Ley de Raoult
P1 ∝ x1
P1 = P1o x1,……………………………. (1)
Donde P1° es la presión de vapor del componente 1 en estado puro.
De manera similar, para el componente 2:
P2 = P2o x2, …………………………….. (2)
Por la ley de presiones parciales de Dalton sabemos que,
Ptotal = P1+P2
Usando los valores de P1 y P2 de las ecuaciones (1) y (2) respectivamente tenemos:
Ptotal = P1ox1 + P2ox2
=> Ptotal = P1o(1-x2) + P2ox2
=> Ptotal = P1o + (P2o-P1o)x2
Podemos deducir lo siguiente de la ecuación anterior:
- La ecuación anterior es una línea recta entre Ptotal y x2 cuya pendiente viene dada por (P2o-P1o) y la intersección-y es igual a P1o.
- La presión de vapor total sobre una solución varía linealmente con la fracción molar del componente 2.
- La presión de vapor total sobre una solución depende de la presión de vapor de los componentes 1 y 2 en estado puro y de la fracción molar del componente 2 en la solución.
¿Qué es el Punto de Ebullición?
A medida que aumentamos la temperatura del líquido, su presión de vapor aumenta proporcionalmente. Llega un momento en que la presión de vapor del líquido se iguala a la presión atmosférica. A esta temperatura, los vapores cercanos a la superficie empiezan a escapar a la atmósfera y el líquido experimenta una transición de fase. Esta temperatura se define como el punto de ebullición del líquido.
El punto de ebullición estándar del líquido se da a:
Presión de 1 atm = 102325 Pa o 1 bar = 105 Pa
¿Qué es el Calor de Vaporización?
A medida que aportamos calor a un líquido, su energía aumenta, lo que se traduce en un incremento de la temperatura global. En el punto de ebullición, el calor adicional es utilizado por las moléculas para vencer la fuerza de atracción intermolecular del líquido y pasar al estado gaseoso.
Cuando 1 mol de líquido se transforma en estado gaseoso, la cantidad de calor aportada por este proceso se conoce como Calor de Vaporización.
Presión de Vapor de los Líquidos Puros
La tendencia de una sustancia a convertirse en estado gaseoso o vapor se mide por la presión de vapor, que aumenta con la temperatura. El punto de ebullición de un líquido se define como la temperatura a la cual la presión de vapor en su superficie es igual a la presión ejercida por su entorno. La presión ejercida por el vapor presente sobre el líquido en equilibrio con el líquido a esa temperatura se puede describir como la presión de vapor de un líquido a cualquier temperatura.
Aplicaciones de la Presión de Vapor en las Industrias
Industria alimentaria y de bebidas
En la industria alimentaria y de bebidas, la presión de vapor es esencial para la conservación y el control de calidad de los productos. Por ejemplo, el control de la presión de vapor durante el proceso de envasado ayuda a prevenir el deterioro y mantener la frescura de los alimentos.
Industria farmacéutica
La presión de vapor desempeña un papel vital en la formulación y el almacenamiento de medicamentos. Por ejemplo, los medicamentos sensibles a la humedad deben almacenarse en un entorno controlado con baja presión de vapor para evitar la degradación de los principios activos.
Industria petrolera
En la industria petrolera, la presión de vapor se utiliza para determinar la volatilidad de los combustibles y otros productos derivados del petróleo. Esta información ayuda a los ingenieros a diseñar sistemas de almacenamiento y transporte más seguros para estas sustancias volátiles.
Esta fue sólo una breve introducción sobre la presión de vapor. Para obtener más información sobre los diferentes estados de los líquidos, ingrese a nuestra página web Una Energía.
Preguntas Sobre Presión de Vapor
¿Cómo se mide la presión de vapor?
La presión de vapor se puede medir utilizando varias técnicas, como el método estático, el método dinámico y el método de derrame. Cada método tiene sus ventajas y limitaciones, según la sustancia que se mida y la precisión deseada.
¿Cómo afecta la temperatura a la presión de vapor?
Como se mencionó anteriormente, la temperatura tiene un impacto directo en la presión de vapor. A medida que aumenta la temperatura, más moléculas obtienen suficiente energía para escapar de la fase líquida, lo que da como resultado una presión de vapor más alta. Esta relación con la presión parcial se describe mediante la ecuación de Clausius-Clapeyron, que nos ayuda a calcular la presión de vapor de una sustancia a diferentes temperaturas.
¿Hay nuevos desarrollos o tendencias relacionadas con la presión de vapor?
Con los avances tecnológicos, los investigadores perfeccionan continuamente los métodos para medir y predecir la presión de vapor. Por ejemplo, se están empleando métodos computacionales, como el modelado molecular, para estudiar con mayor precisión las presiones de vapor de sustancias y mezclas complejas.
¿Qué es la presión de vapor en palabras sencillas?
La presión de vapor es la fuerza ejercida por la fase gaseosa de una sustancia cuando está en equilibrio con su fase líquida. Es la presión generada por las moléculas en evaporación de la fase vapor de un líquido a una temperatura dada.
¿Qué significa tener una presión de vapor alta?
Una presión de vapor alta significa que una sustancia es volátil y se evapora fácilmente, ya que más moléculas tienen energía suficiente para escapar de la fase líquida y entrar en la fase gaseosa.
¿Qué determina la presión de vapor?
La presión de vapor determina la volatilidad de una sustancia, su punto de ebullición y desempeña un papel importante en los diagramas de fases y la estabilidad química.
