
La Ley de Raoult debe su nombre a François-Marie Raoult, un químico francés que, al realizar un experimento, descubrió que cuando se mezclaban sustancias en una solución, la presión de vapor de la solución disminuía simultáneamente. La ley de Raoult se estableció en el año 1887 y también se considera la ley de la termodinámica.
En esta lección profundizaremos en la ley de Raoult y comprenderemos el principio en el que se basa, así como su aplicación y sus limitaciones.
¿Qué es la Ley de Raoult?
La ley de Raoult establece que la presión parcial de vapor de un solvente en una solución (o mezcla) es igual o idéntica a la presión de vapor del solvente puro multiplicada por su fracción molar en la solución.
Matemáticamente, la ecuación de la ley de Raoult se escribe como:
Psolución = ΧsolventeP0solvente
Donde:
Psolución = presión de vapor de la solución
Χsolvente = fracción molar del solvente
P0solvente = presión de vapor del solvente puro
Además, entenderemos el principio en el que se basa la ley observando el siguiente ejemplo.
Consideremos una solución de líquidos volátiles A y B en un recipiente. Como A y B son volátiles, habrá partículas de A y B en la fase de vapor.
Por lo tanto, las partículas de vapor de A y B ejercen una presión parcial que contribuye a la presión total sobre la solución.
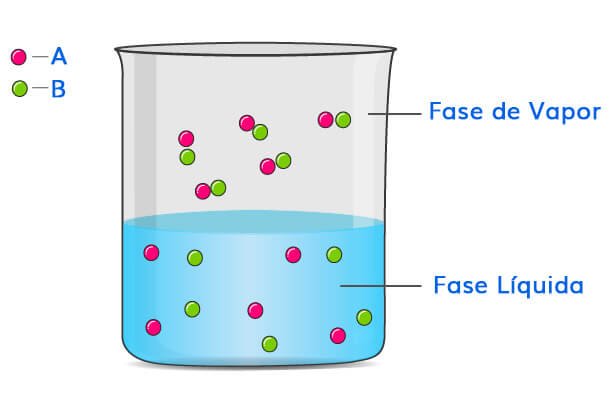
La ley de Raoult establece además que en el equilibrio,
PA = P°AxA, PB = P°BxB
Donde:
PA es la presión parcial de A.
P°A es la presión de vapor de A puro a esa temperatura.
xA es la fracción molar de A en la fase líquida.
Del mismo modo, PB, P°B, xB
Por lo tanto,
PT = PA + PB (Ley de Dalton)
= P°AxA + P°BxB
= P°A + xB (P°B – P°A)
Importancia de la Ley de Raoult
Supongamos que tenemos un recipiente cerrado lleno de un líquido volátil A. Al cabo de un tiempo, debido a la evaporación, comenzarán a formarse partículas de vapor de A. A medida que pasa el tiempo, las partículas de vapor de A estarán en equilibrio dinámico con las partículas de líquido (en la superficie). La presión ejercida por las partículas de vapor de A a una temperatura determinada se denomina presión de vapor de A a esa temperatura.
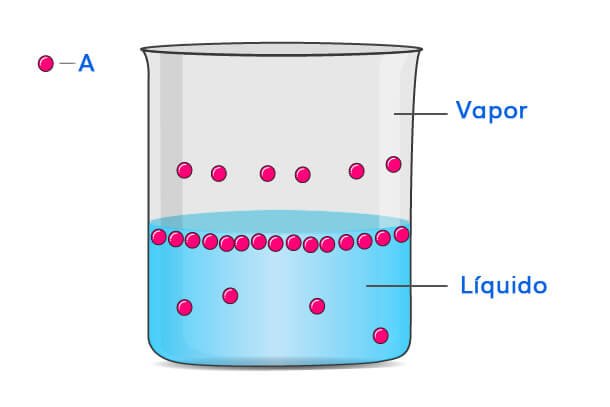
La presión de vapor la presentan todos los sólidos y líquidos y depende únicamente del tipo de líquido y la temperatura.
Ahora imaginemos que añadimos otro líquido, B (soluto), a este recipiente. Esto hará que las partículas B ocupen el espacio entre las partículas A en la superficie de la solución.
Para cualquier líquido, hay una fracción de moléculas en la superficie que tendrán energía suficiente para escapar a la fase de vapor.
Ahora, como tenemos un menor número de partículas de A en la superficie, el número de partículas de vapor de A en la fase de vapor será menor. Esto resultará en una menor presión de vapor de A.
Ahora, si suponemos que B también es volátil, tendremos un menor número de partículas de B en la fase de vapor en comparación con el líquido puro de B.
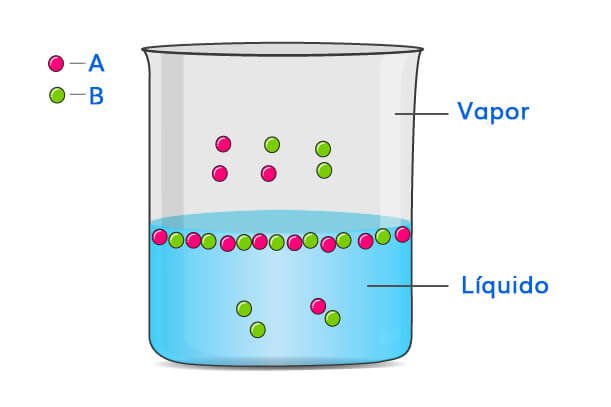
Esta nueva presión (presión parcial) de cada uno (A y B) viene dada por la ley de Raoult y depende de la concentración de cada componente en la fase líquida.
PA ∞ XA, PB ∞ XB
= XAP°A = XBP°B
A partir de la ley de Raoult, es evidente que a medida que se reduce la fracción molar de un componente, también se reduce su presión parcial en la fase vapor.
Los gráficos siguientes muestran que la presión es la fracción molar para A y B.
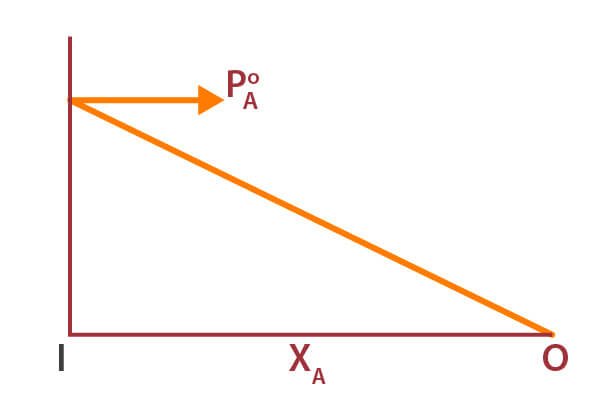
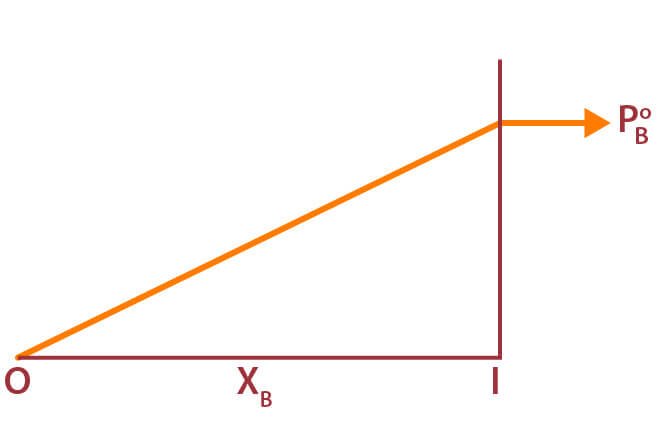
Combinando ambos gráficos,
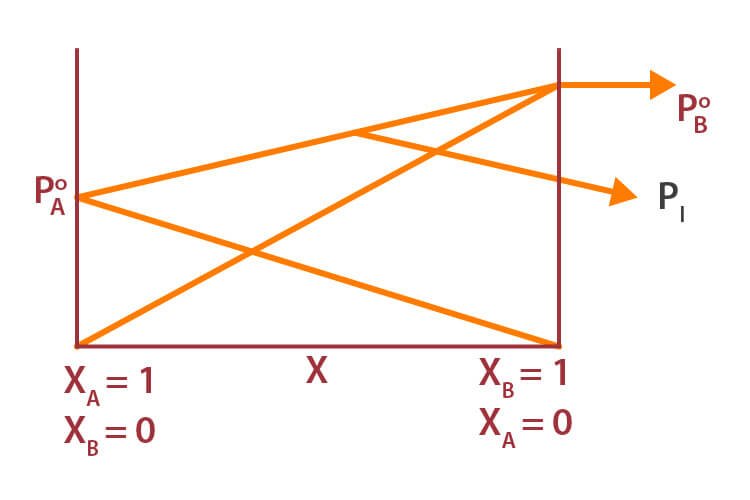
En el diagrama anterior, también hemos añadido el gráfico de la presión de vapor total de la solución, es decir, PA + PB.
En cuanto a la aplicación de la ley, también es útil para calcular la masa molecular de un soluto desconocido.
La Ley de Raoult y su Relación con Otras Leyes
La ley de Raoult también es bastante similar a la ley de los gases ideales. La única excepción de la ley de Raoult es que se aplica a las soluciones. Si has leído sobre la ley de los gases ideales, sabrás que supone el comportamiento ideal de los gases en los que las fuerzas intermoleculares que existen entre moléculas distintas son nulas o inexistentes. Por otro lado, la ley de Raoult supone que las fuerzas intermoleculares que existen entre moléculas diferentes y moléculas similares son iguales.
La ley de Raoult también puede aplicarse a soluciones no ideales. Sin embargo, esto se hace incorporando varios factores en los que tenemos que considerar las interacciones entre moléculas de distintas sustancias.
Si tomamos un sistema perfectamente ideal formado por un líquido ideal y un vapor ideal, podemos obtener una ecuación muy útil combinando la ley de Raoult y la ley de Dalton.
xi = (yiPtotal) / Pi
Aquí
xi = fracción molar del componente i en la solución,
yi = fracción molar en la fase gaseosa.
Lo que podemos deducir de esta ecuación es que cuando tenemos una solución ideal con componentes puros, cada uno de ellos tendrá una presión de vapor diferente. Además, en la fase gaseosa, el componente tendrá una presión de vapor pura más alta, mientras que la solución tendrá una presión de vapor pura más baja.
Limitaciones de la Ley de Raoult
La ley de Raoult tiene algunas limitaciones.
- La ley de Raoult es adecuada para describir soluciones ideales. Sin embargo, las soluciones ideales son difíciles de encontrar y son raras. Los distintos componentes químicos tienen que ser químicamente idénticos por igual.
- Como muchos de los líquidos que están en la mezcla no tienen la misma uniformidad en términos de fuerzas de atracción, este tipo de soluciones tienden a desviarse de la ley.
Existe una desviación negativa o positiva. La desviación negativa se produce cuando la presión de vapor es inferior a la esperada a partir de la ley de Raoult. Un ejemplo de desviación negativa es una mezcla de cloroformo y acetona o una solución de agua y ácido clorhídrico.
Por otro lado, la desviación positiva tiene lugar cuando la cohesión entre moléculas similares es mayor o cuando supera la adhesión entre moléculas distintas o disímiles. Ambos componentes de la mezcla pueden escapar fácilmente de la solución. Un ejemplo de desviación positiva son las mezclas de benceno y metanol o de etanol y cloroformo.
