
Los coloides, también conocidos como soluciones coloidales o sistemas coloidales, son mezclas en las que partículas insolubles microscópicamente dispersas de una sustancia están suspendidas en otra sustancia.
El tamaño de las partículas suspendidas en un coloide puede oscilar entre 1 y 1000 nanómetros (10-9 metros). Para que una mezcla se clasifique como coloide, sus partículas en suspensión no deben sedimentar (del mismo modo que las partículas de las suspensiones se asientan en el fondo del recipiente si no se las perturba).
Se sabe que las soluciones coloidales presentan el Efecto Tyndall, que es un fenómeno en el que los haces de luz que inciden en los coloides se dispersan debido a las interacciones entre la luz y las partículas coloidales.
La definición de la IUPAC del estado coloidal puede escribirse de la siguiente manera:
«El estado coloidal es el estado de subdivisión en el que moléculas o partículas polimoleculares que tienen al menos una dimensión en el rango de 1 nanómetro a 1 micrómetro, están dispersas en algún medio.»
Los coloides suelen presentar sustancias que se dispersan uniformemente en otra. En este tipo de mezclas, la sustancia que se dispersa se denomina fase dispersa, mientras que la sustancia a través de la cual se dispersa se denomina fase continua.
¿Qué son los Coloides?
En términos sencillos, podemos definir los coloides como una mezcla en la que una de las sustancias se divide en partículas muy diminutas que se dispersan por una segunda sustancia. Las partículas diminutas se conocen como partículas coloidales.
Alternativamente, también podemos decir que los coloides son básicamente soluciones en las que el tamaño de las partículas de soluto oscila entre 1 nm y 1000 nm. Los coloides son heterogéneos por naturaleza.
Preparación de Soluciones Coloidales
Los coloides estables también se conocen como soles liófilos. En ellos, existen fuertes fuerzas de interacción entre la fase dispersa y el medio de dispersión. Estos coloides se preparan mediante los siguientes métodos adecuados.
1. Método de Condensación
En este método, pequeñas partículas de soluto se condensan para formar una partícula de fase dispersa.
Métodos Químicos
a) Por oxidación
El azufre coloidal puede obtenerse haciendo pasar gas oxígeno a través de una solución de sulfuros de hidrógeno. En este método también se puede utilizar cualquier agente oxidante como HNO3 y H3Br2.
2H2S + O2 → 2H2O + 2S
b) Por doble descomposición
Se obtiene una solución de sulfuro de arsénico por doble descomposición. En este proceso, el sulfuro de hidrógeno se hace pasar por una solución fría de óxido arsenioso.
AS2O3 + 3H2S → AS2S3 + 3H2O
c) Por reducción
Algunos metales como el oro, la plata y el platino se obtienen en estado coloidal haciendo reaccionar la solución acuosa de estas sales con agentes reductores adecuados como formaldehído, fenilhidrazina, peróxido de hidrógeno, cloruro de estaño, etc.
2AuCl3 + 3SnCl2 → 3SnCl4 + 2Au
2AuCl3 + 3HCHO + 3H2O → 2Au + 3HCOOH + 6HCl
El sol de oro preparado en la reducción de la solución de cloruro de oro tiene un color púrpura y se llama púrpura de Casio.
d) Por hidrólisis
Muchas soluciones salinas se hidrolizan rápidamente hirviendo una solución diluida de sus sales. Por ejemplo, los soles de hidróxido férrico y de hidróxido de aluminio se obtienen hirviendo soluciones del cloruro correspondiente.
FeCl3 + 3H2O → Fe(OH)3 + 3HCl
El sol de ácido silícico se obtiene por hidrólisis del silicato de sodio.
e) Por enfriamiento excesivo:
En este proceso se obtiene un sol coloidal de hielo. El hielo se toma en un disolvente orgánico como el éter cloroformo. El sol de hielo se obtiene congelando una solución de agua en el disolvente. Las moléculas de agua ya no están en la solución por separado se combinan para formar partículas de tamaño coloidal.
f) Por intercambio de disolvente
En este proceso, el sol coloidal de ciertas sustancias como el azufre y el fósforo, que son solubles en alcohol pero insolubles en agua, puede prepararse vertiendo su solución alcohólica en agua. Una solución alcohólica suficiente de azufre, al verterla en agua, da una solución coloidal lechosa de azufre.
g) Por cambio de estado físico
Los soles de sustancias como el mercurio y el azufre se preparan haciendo pasar el vapor a través de agua fría que contiene un estabilizador adecuado, como sal de amonio o citrato.
2. Métodos de Dispersión
En estos métodos, las partículas grandes de una sustancia (suspensión) se rompen en partículas más pequeñas. Se emplean los siguientes métodos.
a) Dispersión mecánica
En este método, la sustancia se tritura primero hasta obtener partículas gruesas. A continuación, se mezcla con un medio de dispersión para obtener una suspensión. A continuación, la suspensión se tritura en un molino coloidal.
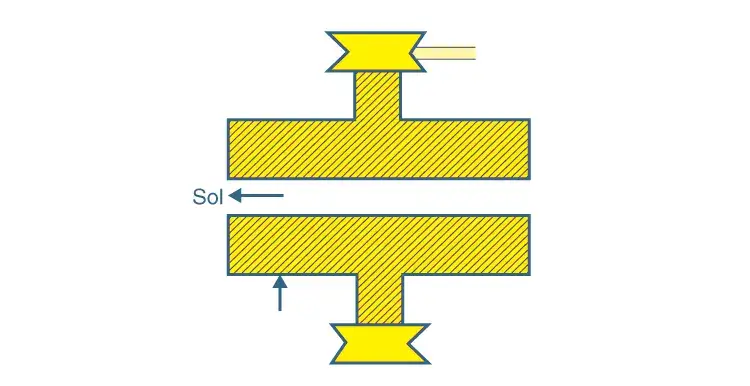
Consiste en dos colorantes metálicos que casi se tocan y giran en sentido contrario a una velocidad muy elevada, 7000 revoluciones por minuto. El espacio entre los tintes del molino está ajustado de tal manera que la suspensión gruesa a gran fuerza de cizallamiento da lugar a partículas de tamaño coloidal. Por este método se obtienen soluciones coloidales de tinta negra, pinturas, barnices y tintes.
b) Método del Arco de Bredig o por Dispersión Eléctrica
Este método se utiliza para preparar soles de platino, plata, cobre u oro. El metal cuyo sol se desea preparar se fabrica como dos electrodos, que se sumergen en un medio de dispersión como el agua, etc.
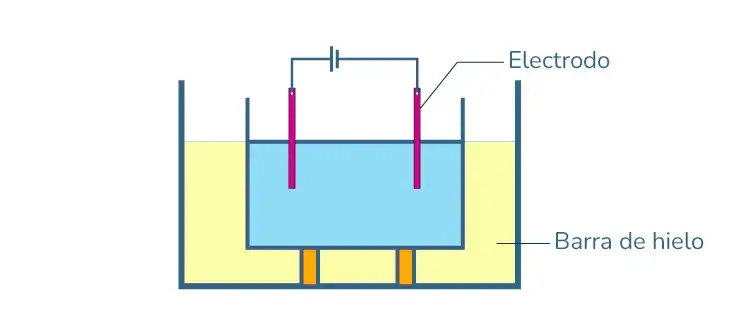
El medio de dispersión se mantiene frío mediante hielo. Se coloca un arco eléctrico entre los electrodos. Se genera un calor tremendo y se obtiene el soluto coloidal. En este proceso se utilizan electrolitos para estabilizar y enfriar.
c) Peptización
El proceso de convertir un precipitado recién preparado en una solución coloidal se conoce como peptización. En este método, el electrolito se añade en cantidades más pequeñas, lo que se conoce como agente de peptización o agente peptizante. La causa de la peptización es la adsorción de los iones del electrolito por las partículas del precipitado. Algunos agentes peptizantes importantes son el azúcar, la gema, la gelatina y el electrolito.
Ejemplos
1. El hidróxido férrico recién preparado puede convertirse al estado coloidal agitándolo con agua que contenga iones Fe3+ u OH–, es decir, FeCl3 o NH4OH, respectivamente.
Fe(OH)3 + FeCl3 → (Fe(OH)1 Fe)+3 + 3Cl– electrolito precipitado.
2. Se obtiene un sol estable de óxido estánico añadiendo una pequeña cantidad de HCl diluido al precipitado de óxido estánico. Del mismo modo, se obtiene una solución coloidal de Al(OH)3 y AgCl tratando las soluciones correspondientes, recién preparadas con una solución muy diluida de HCl y AgNO3 o KCl, respectivamente.
Purificación de Coloides
Los coloides contienen impurezas iónicas y otras categorías de sustancias impuras que disminuyen la calidad de los coloides utilizados en diversas aplicaciones. A continuación se indican los métodos para purificar los coloides.
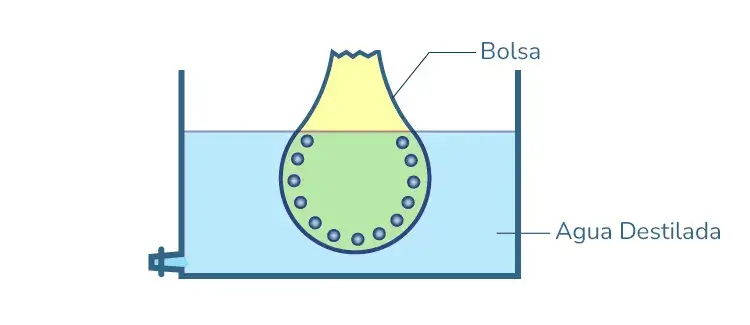
1. Diálisis
El método de separación de sustancias iónicas de la solución coloidal mediante efusión a través de una membrana adecuada es la diálisis. El principio es que las partículas de sol no pueden atravesar el papel pergamino o la membrana semipermeable, debido a lo cual la impureza se difunde lentamente fuera de la base, dejando el coloide puro.
Precauciones:
El agua destilada del recipiente donde se sumerge una bolsa debe cambiarse con frecuencia para evitar la acumulación de cristaloides; de lo contrario, existe la posibilidad de que las impurezas vuelvan a difundirse en la bolsa.
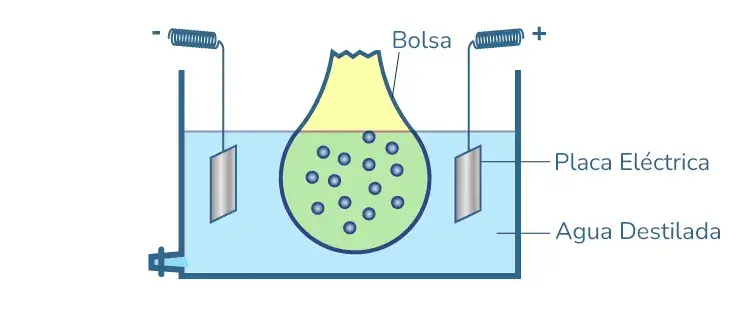
2. Electrodiálisis
La diálisis es un proceso lento y requiere mucho tiempo para eliminar las impurezas. El proceso se improvisa mediante una fuerza eléctrica aplicada. Es lo que se conoce como electrodiálisis. En este método, dos placas eléctricas se insertan en el agua destilada y se conectan a los terminales de la fuente; de largo pasa a la placa eléctrica opuesta con mayor velocidad y el sol se purifica.
3. Ultrafiltración
Los papeles de filtro normales no pueden utilizarse para filtrar las impurezas de los coloides ya que, debido al gran tamaño de los poros, se filtrarán las impurezas junto con las partículas de sol. El tamaño de los poros se reduce impregnando los papeles en solución de colodión, que es 4 – s. Calcular la solución de nitrato en la mezcla de alcohol y éter y secar con acetaldehído. Esto se conoce como ultrafiltración, y tales papeles se conocen como papeles ultrafiltrantes.
Ejemplos de Coloides
- Sangre: Un pigmento de respiración que tiene proteína albúmina en agua. La parte del pigmento contiene albúmina, que actúa como fase dispersa, y el medio de dispersión es el agua. Se trata de un hidrosol.
- Nube: Contiene aire, que es el medio de dispersión, y gotitas de agua como fase dispersa. Se trata de aerosoles.
- Sol de oro: Es un sol metálico en el que se dispersan partículas de oro en agua.
Aplicación de los Coloides
Los coloides son muy útiles en aplicaciones industriales, médicas y domésticas.
Como alimentos: El jarabe, el halwa y la sopa pertenecen a un sistema de tipo coloidal.
Medicina: La plata coloidal en nombre de Argyrols actúa como antiséptico para las infecciones oculares.
En la purificación del aire mediante el precipitador Cottrell
Este proceso implica la coagulación de las partículas de solución. El polvo o el humo se hace pasar a través de la entrada de una cámara electrificada que tiene una placa eléctrica central que está provista de la carga opuesta de las partículas de polvo o humo. Cuando pasa el polvo, las partículas se coagulan y el aire puro pasa por otra salida.
Curtido del cuero
Las pieles animales son muy blandas. Cuando se sumergen en una solución de tanino, que tiene la carga opuesta a la de la piel animal, las partículas se coagulan y la piel se endurece. Esto se conoce como curtido del cuero.
Formación del delta
Consiste en la coagulación de partículas de arcilla del río con un electrolito de agua de mar.
Preguntas Importantes
1. ¿Cuál es la principal diferencia entre los soles liofílicos y liofóbicos?
En los soles liofílicos, existe una fuerte interacción entre la fase dispersa y el medio de dispersión, y son muy estables y resistentes a la coagulación. Los soles liofóbicos son inestables; existen fuerzas de atracción de Van Der Waals débiles e inestables entre la fase dispersa y el medio de dispersión, debido a lo cual son irreversibles y listos para coagularse.
2. ¿Qué son los geles? Ponga un ejemplo.
Los geles son un tipo de soles en los que el sólido es un medio de dispersión y el líquido es una fase dispersa, y son estables a temperaturas comparativamente bajas.
3. Dé un ejemplo de coloides multimoleculares.
Los coloides multimoleculares se forman por agregación de partículas sólidas de tamaño relativamente pequeño.
Ejemplo: sol de sulfuro, sol de Ag, etc.
4. Dé ejemplos de coloides macromoleculares.
Se trata generalmente de biomoléculas, como enzimas o proteínas, cuyo tamaño es bastante mayor cuando se sumergen en un medio de dispersión adecuado y sus partículas se agregan para formar soles.
5. ¿Por qué la diálisis no es el mejor método para la purificación de coloides?
La separación de las impurezas iónicas, que están disueltas en el sol, mediante una membrana semipermeable, es la diálisis. Si la diálisis es prolongada, se eliminan todas las impurezas iónicas, y las partículas de sol se juntan y neutralizan, dando lugar al precipitado.
6. Nombra el método utilizado para preparar soles metálicos como el sol de oro.
El método de dispersión por arco de Bredig se utiliza para preparar soles metálicos como el sol de oro. En este método, las partículas metálicas se rompen en el tamaño de las partículas de sol y se sumergen en un medio de dispersión adecuado para formar soles.
7. ¿Qué fenómeno de los coloides implica la formación de un delta?
En la formación del delta interviene la coagulación o floculación. El río contiene partículas de arcilla, que al combinarse con agua de mar con electrolito, debido a la presencia de iones opuestos, se coagulan y forman delta.
8. Se necesita una pequeña cantidad de electrolito para la formación de un sol, mientras que se requiere una gran cantidad para la coagulación de un sol. Comentario.
Un precipitado recién formado se convierte en un sol mediante la adición de una pequeña cantidad de electrolito como agente peptizante, ayudando a la formación de un sol. Cuando se añade una gran cantidad de electrolito, los iones de carga opuesta neutralizan la carga de las partículas del sol y se coagulan.
9. Nombre la sustancia utilizada para reducir el tamaño de los poros del papel de filtro durante la ultrafiltración.
En la ultrafiltración, el papel de filtro normal no puede utilizarse debido al gran tamaño de sus poros. El tamaño de los poros se reduce utilizando una solución de colodión, que es una solución de nitrato de celulosa al 4% en una mezcla de alcohol y éter.
Preguntas Frecuentes
Emulsión, sol, aerosol y espuma son los 4 tipos de coloides.
La niebla es un ejemplo de coloide en el que la fase de dispersión es líquida y el medio de dispersión es gas.
El tamaño de las partículas coloidales oscila entre 1 y 1000 nm.
Los coloides liofóbicos, liofílicos y de Asociación son los tres tipos de soluciones coloidales.
La sangre es una suspensión coloidal. Está formada por linfocitos, glóbulos rojos y glóbulos blancos suspendidos en plasma.
