
¿Qué es una Solución Ideal?
Una solución ideal es una mezcla en la que se distinguen las moléculas de las distintas especies, pero, a diferencia del gas ideal, las moléculas de la solución ideal ejercen fuerzas entre sí. Cuando esas fuerzas son las mismas para todas las moléculas, independientemente de la especie, se dice que la solución es ideal.
Si tomamos la definición más sencilla de una solución ideal, ésta se describe como una solución homogénea en la que la interacción entre las moléculas de los componentes (soluto y solventes) es exactamente igual a las interacciones entre las moléculas de cada componente en sí. Este tipo de soluciones sigue la Ley de Raoult en casi todos los niveles de concentración y temperaturas.
Obtenga más información sobre: ¿Qué es una Solución?
Características de las Soluciones Ideales
Las soluciones ideales se obtienen mezclando un soluto y un solvente que tienen una estructura molecular y un tamaño similares. Si tomamos dos sustancias X e Y y las mezclamos veremos que existen varias fuerzas intermoleculares entre ellas.
Por ejemplo,
- X y X experimentan fuerzas de atracción intermoleculares.
- Y e Y experimentan fuerzas de atracción intermoleculares.
- X e Y experimentan fuerzas de atracción intramoleculares.
En este caso, cuando las fuerzas de atracción intermoleculares son iguales o se igualan, nos da una solución ideal.
Entender el concepto de solución ideal es realmente importante, especialmente cuando estudiamos la termodinámica química y temas como las propiedades coligativas.
Ley de Raoult
La ley de Raoult establece que «la disminución relativa de la presión de vapor de un solvente al disolver un electrolito no volátil es igual a la fracción molar del soluto».
Por lo tanto, ΔP/PAo = Número de moles de soluto / Total de moles de soluto y solvente
Por lo tanto,
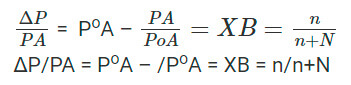
Donde n y N son los números de moles de soluto y solvente respectivamente.
En una solución diluida
N>>n
Por lo tanto,
XB = n/N = w/m/W/M
Donde w y W son los pesos del soluto y del solvente y m y M son sus pesos moleculares respectivamente.
Por lo tanto,
PoA – PA/PoA = P/PoA = wM/Wm
Propiedades de una Solución Ideal
Una solución ideal tiene, la mayoría de las veces, propiedades físicas que están estrechamente relacionadas con las propiedades de los componentes puros. Algunas de sus propiedades son:
La entalpía de la solución es cero. Si la entalpía de la solución se acerca a cero es más probable que muestre un comportamiento ideal. ΔmezclaH = 0
El volumen de mezcla también es cero. ΔmezclaV = 0
Ejemplos de Soluciones Ideales
Conseguir una solución ideal bien equilibrada puede ser raro, pero algunas soluciones pueden mostrar a veces un comportamiento ideal. Algunos ejemplos son:
- Tolueno y benceno.
- Yoduro de etilo y bromuro de etilo.
- Bromobenceno y Clorobenceno.
- N-heptano y n-hexano.
En particular, cuando hablamos de las concentraciones de las soluciones, la mayoría de las soluciones diluidas también tienen o muestran características de una solución ideal.
Preguntas Frecuentes
Solución en la que la interacción de las moléculas de los componentes no varía respecto a las interacciones de las moléculas de cada componente. Las soluciones ideales son aquellas que en todas las concentraciones y temperaturas obedecen a la ley de Raoult.
Una solución ideal tiene las siguientes características: (i) el cambio de volumen de la mezcla debe ser cero. (ii) el cambio de calor de la mezcla debe ser cero.
La ley de Raoult establece que la presión de vapor de la solución es igual a la suma de la presión de vapor de cada componente volátil si se multiplica estrictamente por la fracción molar de ese componente en la solución.
Un gas ideal se define como aquel en el que todas las colisiones entre átomos o moléculas son perfectamente elásticas y en el que no existen fuerzas intermoleculares atractivas. Se puede imaginar como una serie de esferas perfectamente duras que colisionan, pero que no se comunican entre sí.
